Forschende am Paul Scherrer Institut PSI haben eine künstliche Intelligenz entwickelt, die einen neuen, kostengünstigen Ansatz zur Identifikation genetischer Störungsmuster in Zellbildern eröffnen könnte – mit Potenzial für die Entwicklung neuer Medikamente.
In der modernen Medizin stehen die frühe Erkennung und gezielte Beeinflussung krankheitsrelevanter Gene im Zentrum therapeutischer Strategien. Besonders bei komplexen Erkrankungen wie Krebs, neurodegenerativen Leiden wie Alzheimer oder chronischen Entzündungen, die mit Alterungsprozessen einhergehen, liegt die Herausforderung nicht allein im Erkennen einzelner Gene, sondern im Verstehen ihrer Regulationsnetzwerke. Eine zunehmend anerkannte Schlüsselrolle spielt dabei die dreidimensionale Organisation der DNA im Zellkern – das sogenannte Chromatin.
Die Analyse solcher genetischer Veränderungen erforderte bislang aufwendige und teuere Genexpressions- oder Sequenzierungsverfahren. In einer im Magazin Cell Systems veröffentlichten Arbeit präsentieren Forschende um G.V. Shivashankar – Leiter des Labors für multiskalare biologische Bildgebung am Zentrum für Life Sciences des PSI und Professor für Mechano-Genomik an der ETH Zürich – sowie Caroline Uhler, Direktorin des Eric and Wendy Schmidt Center am Broad Institute und Professorin für Elektrotechnik und Informatik am MIT, nun einen neuen Ansatz: Gemeinsam mit den Nachwuchsforschenden Daniel Paysan, Adityanarayanan Radhakrishnan und Xinyi Zhang entwickelten sie eine künstliche Intelligenz (KI) namens Image2Reg. Mit ihr lassen sich möglicherweise genetische Störungen und potenzielle Zielstrukturen von Medikamenten allein auf Basis einfacher mikroskopischer Aufnahmen vom Zellkern erkennen, wie sie etwa nach der blau fluoreszierenden Hoechst-Färbung vorliegen. «Die Verbindung von Bildgebung, maschinellem Lernen und molekularen Netzwerken kann am Ende einen diagnostischen und therapeutischen Zugang ermöglichen, der sowohl schnell als auch kostengünstig ist», erklärt Shivashankar.
KI entwickelt ein «Auge» für Aktivität im Chromatin, …
Im ersten Schritt von Image2Reg (die Abkürzung steht für Image to Regulation, zu Deutsch: vom Zellbild zur Genregulation) nutzen die Forschenden die Tatsache, dass sich die dreidimensionale Struktur des Zellkerns – gemeint ist das Chromatin, sprich die Verpackung der DNA – sichtbar verändert, wenn ein bestimmtes Gen in seiner Aktivität gestört oder experimentell übersteuert wird. In diesem Fall zeigen die Bilder oftmals sehr feine, aber systematische Veränderungen im Erscheinungsbild des Chromatins.
Die Forschenden trainierten anschliessend einen lernfähigen Algorithmus – ein sogenanntes Convolutional Neural Network (CNN), eine auf Bildverarbeitung spezialisierte Form der künstlichen Intelligenz – darauf, diese Muster zu erkennen. Die KI entwickelte so ein «Auge» für die typischen Spuren, die eine Aktivität im Chromatinbild hinterlässt.
… baut ein Netzwerk aus zellulären Beziehungen auf…
Parallel zur Bildauswertung baut Image2Reg ein zelltypspezifisches biologisches Netzwerk auf, das beschreibt, wie Gene im Inneren der Zelle miteinander in Beziehung stehen. Dieses Netzwerk beruht auf zwei bewährten Grundlagen der Molekularbiologie: Zum einen auf bekannten Protein-Protein-Interaktionen – also darauf, welche Eiweisse miteinander in Kontakt treten und dabei biochemische Prozesse auslösen. Zum anderen fliessen Genexpressionsdaten ein – sowohl aus Einzelzellanalysen als auch aus klassischen Sammelmessungen, bei denen die Aktivität vieler Zellen im Durchschnitt erfasst wird. Diese Daten zeigen, welche Gene gleichzeitig aktiv sind und sich möglicherweise gegenseitig beeinflussen oder regulieren.
Diese Informationen werden schliesslich in einem Rechenmodell zusammengeführt. Das Modell verarbeitet die komplexen Verknüpfungen zwischen den Genen und erstellt daraus für jedes einzelne Gen eine Zahlenrepräsentation, die dessen Funktion, Rolle und Vernetzung im biologischen System widerspiegelt. Entstehen soll so eine Art «Regelbuch der Zelle», eine Beschreibung, welche Gene gemeinsam wirken, einander regulieren oder bestimmten Signalwegen zugeordnet sind – unabhängig davon, wie sie sich äusserlich im Zellbild zeigen.
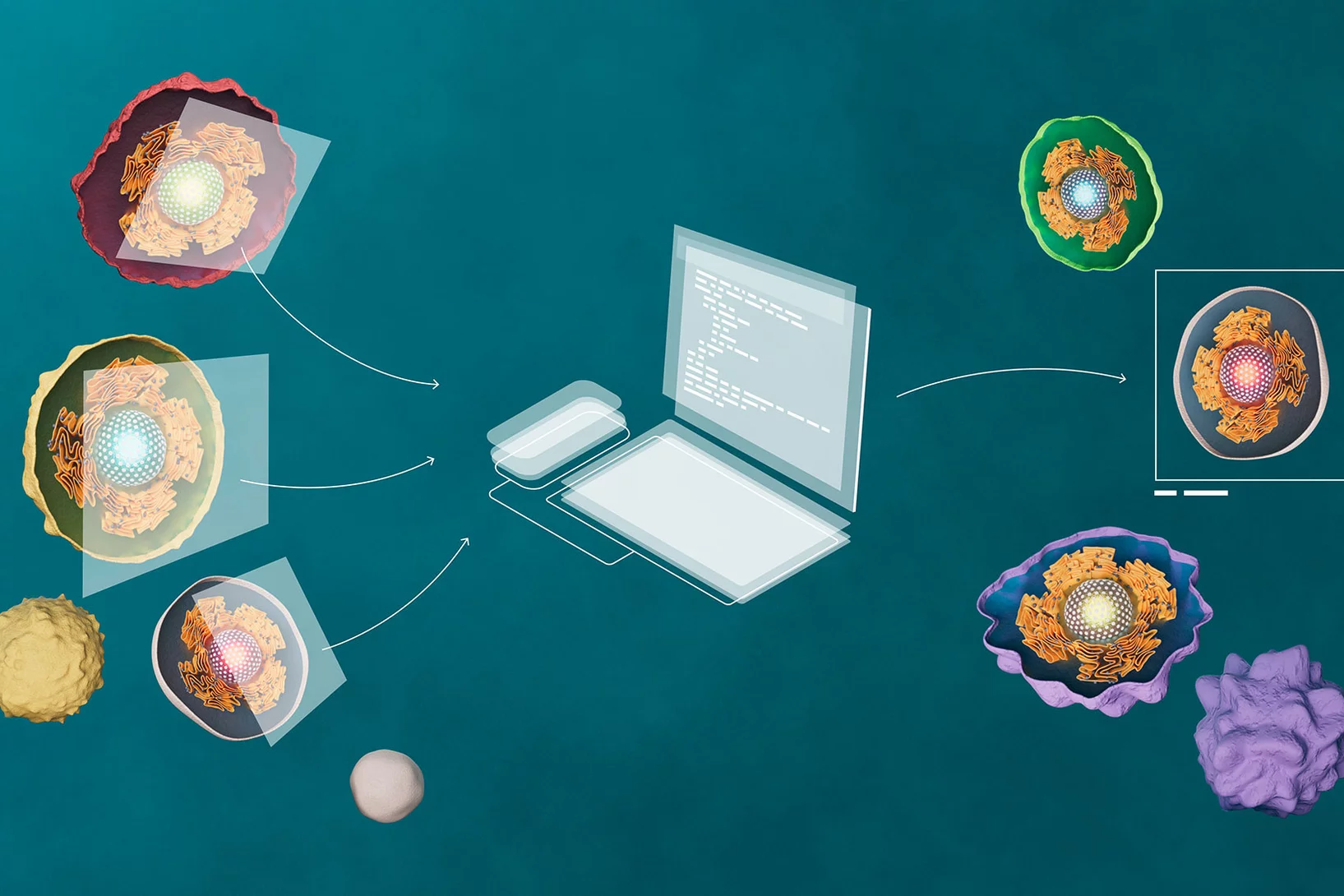
- Zellbild-Analyse
Die KI erkennt subtile Strukturveränderungen im Chromatin mithilfe eines Convolutional Neural Network (CNN). - Netzwerkaufbau
Parallel entsteht ein zelltypspezifisches Netzwerk – basierend auf bekannten Proteininteraktionen und Genexpressionsdaten. Jedes Gen erhält dabei eine mathematische Repräsentation seiner Funktion im Zellgefüge. - Integration beider Ebenen
Mithilfe des Neural Tangent Kernel (NTK) werden Bild- und Netzwerkdaten zusammengeführt, um die Genaktivität sichtbar zu machen.
… und verknüpft Bild und Biologie
Im letzten und entscheidenden Schritt bringt Image2Reg die beiden zuvor gewonnenen Erkenntniswelten – die bildbasierte Darstellung des Zellkerns und das molekulare Wissen über die Genvernetzung – miteinander in Verbindung. Dies geschieht mithilfe eines mathematischen Verfahrens, einer sogenannten Kernel-Maschine, genauer gesagt mit dem Neural Tangent Kernel (NTK). Dieses Modell lernt, wie sich die Zahlenmuster aus der Bildanalyse – also das, was das neuronale Netz aus dem Zellbild herausliest – mit den funktionalen Beziehungen der Gene im biologischen Netzwerk in Übereinstimmung bringen lassen.
Korrekte Vorhersagen weit über Zufallsniveau
Für das Training der KI standen den Forschenden nahezu eine Million Einzelzellbilder zur Verfügung – ein Teil davon aus unbehandelten Kontrollzellen, der andere aus Zellen, bei denen gezielt jeweils ein Gen überaktiviert wurde.
Im anschliessenden Test sollte das Modell allein anhand der Zellbilder erkennen, welches von 41 möglichen Genen verändert worden war. Dabei erreichte die KI eine Genauigkeit von 26 Prozent. Sie konnte also bei jeder vierten Zelle korrekt bestimmen, welches Gen verändert wurde. Zum Vergleich: Nach dem Zufallsprinzip läge die Trefferquote bei rund zwei Prozent. Die Forschenden werten dieses Ergebnis als klaren Hinweis, dass erkennbare Muster in der Zellstruktur existieren, die mit bestimmten Genen verbunden sind und sich mittels Bildanalyse erkennen lassen. «Es ist ein Brückenschlag zwischen Form und Funktion, zwischen Bild und Biologie», erklärt Caroline Uhler.
Ein Werkzeug für Diagnostik und Therapie
Noch steht das Image2Reg-Verfahren am Anfang. Doch es eröffnet eine Reihe praktischer und medizinisch relevanter Anwendungsmöglichkeiten. Viele Krankheiten – etwa Krebs, Alzheimer oder Autoimmunerkrankungen – entstehen durch Störungen in der Genregulation. Die Autoren sehen in Image2Reg ein Werkzeug, mit dem sich erkennen lässt, welche Gene durch eine Krankheit oder eine Therapie beeinflusst wurden – ganz ohne aufwendige experimentelle Analysen. Ziel ist es letztlich, mit diesem Verfahren, Krankheiten frühzeitig zu erkennen – lange bevor klassische Marker wie Proteine, RNA oder bekannte Symptome messbar werden.
In einem neugegründeten Start-up wollen die Forschenden ihre Erkenntnisse nutzen, um eine Therapie für die bisher nicht heilbaren Fibrosen zu entwickeln. Bei diesem Krankheitsbild ersetzt der Körper funktionsfähiges durch narbenartiges, festes Gewebe. Dies führt langfristig zu einer Einschränkung der Organfunktion. Häufig betroffen sind die Lunge, die Leber oder das Herz.
Kontakt
Originalveröffentlichung
-
Paysan D, Radhakrishnan A, Zhang X, Shivashankar GV, Uhler C
Image2Reg: linking chromatin images to gene regulation using genetic and chemical perturbation screens
Cell Systems. 2025; 16(6): 101293 (13.e7 pp.). https://doi.org/10.1016/j.cels.2025.101293
DORA PSI
Weitere Artikel zum Thema
Über das PSI
Das Paul Scherrer Institut PSI entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Zukunftstechnologien, Energie und Klima, Health Innovation und Grundlagen der Natur. Die Ausbildung von jungen Menschen ist ein zentrales Anliegen des PSI. Deshalb sind etwa ein Viertel unserer Mitarbeitenden Postdoktorierende, Doktorierende oder Lernende. Insgesamt beschäftigt das PSI 2300 Mitarbeitende und ist damit das grösste Forschungsinstitut der Schweiz. Das Jahresbudget beträgt rund CHF 450 Mio. Das PSI ist Teil des ETH-Bereichs, dem auch die ETH Zürich und die ETH Lausanne angehören sowie die Forschungsinstitute Eawag, Empa und WSL. (Stand 06/2025)