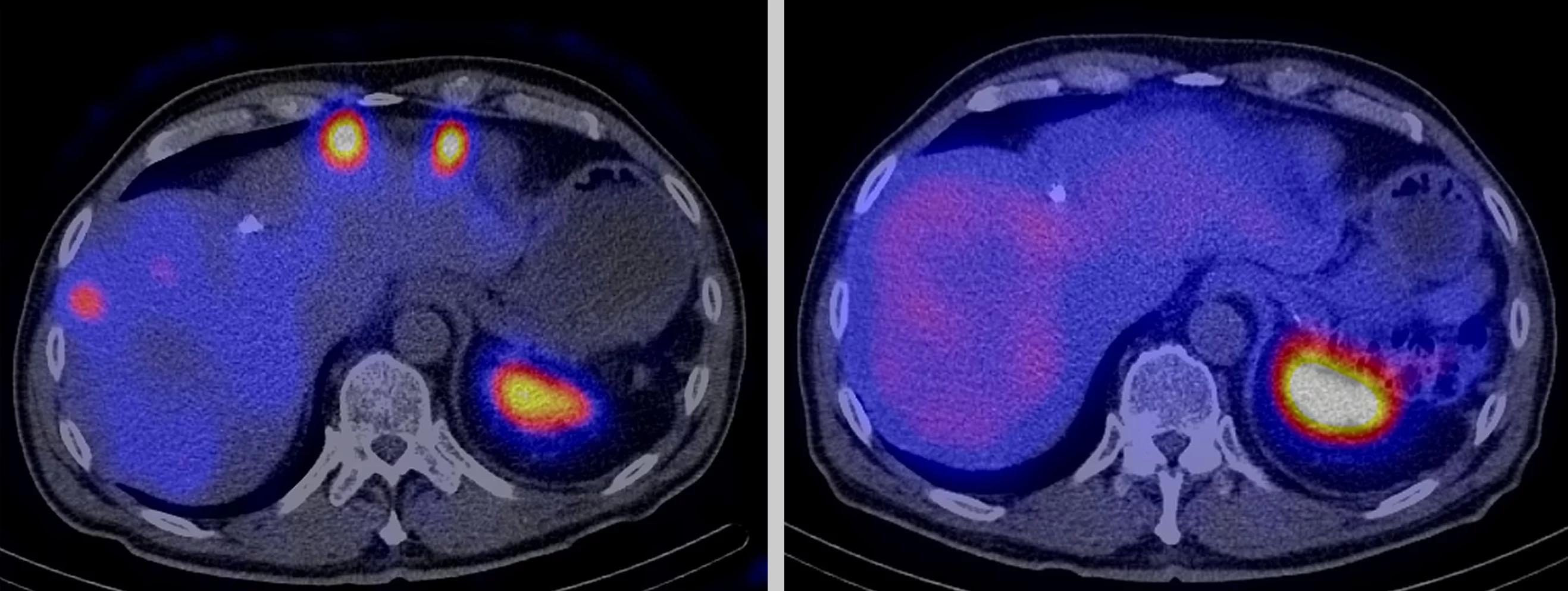
Es gibt Tumore, bei denen scheinbar gar nichts hilft: weder Chemotherapie noch Bestrahlung von aussen oder eine Operation. Oft haben sie schon Tochtergeschwülste gebildet und lassen sich mit herkömmlichen Methoden nicht mehr zerstören. Dann bleibt als einziger Ausweg die Bestrahlung von innen, mit radioaktiven Wirkstoffen zielgerichtet und direkt am Ort des Geschehens. Um das zu ermöglichen, forschen 20 Spezialisten am Zentrum für radiopharmazeutische Wissenschaften am Paul Scherrer Institut PSI, einer gemeinsamen Einrichtung von PSI, ETH Zürich und Universitätsspital Zürich.
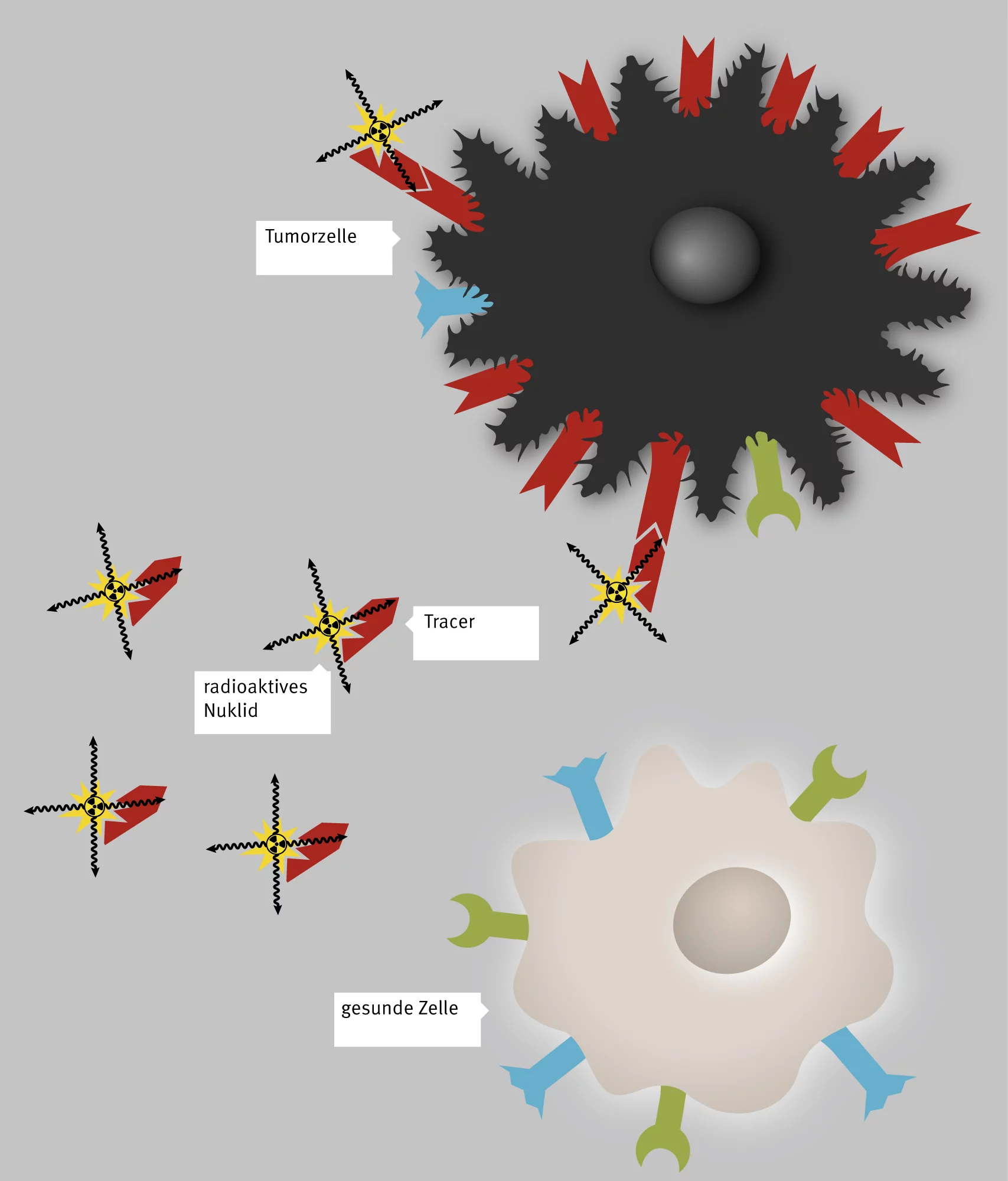
Radioaktivität sieht, riecht und spürt man nicht. Daher haben viele Menschen Angst vor dieser unsichtbaren Energie und denken an Kernkraftwerke und Fukushima. Doch für Patienten mit Krebs kann Radioaktivität lebensrettend sein. Mit ihrer Hilfe können Ärzte einen Tumor und verstreute Krebszellen aufspüren und sie vernichten. Dazu verwenden sie sogenannte Radiopharmaka, radioaktive Arzneimittel, denen man je nach Art der Tumorzellen und der Anwendung bestimmte physikalische und chemische Eigenschaften gibt. Dabei machen sich Wissenschaftler zunutze, dass Tumorzellen spezielle Strukturen auf ihrer Oberfläche haben, an denen Radiopharmaka andocken können, sofern sie ein passendes Molekül enthalten.
Jedes radioaktive Arzneimittel besteht aus einem solchen passgenauen Molekül, dem sogenannten Tracer, und einem radioaktiven Isotop, das Strahlung aussendet. Die Substanzen suchen sich ihr Ziel im Körper einfach selbst
, erklärt Christof Rottenburger, Nuklearmediziner an der Universität Basel und Projektpartner des PSI. Sie deponieren die Strahlung am Ort und verursachen damit im Allgemeinen nur geringe Nebenwirkungen.
Das ist für Patienten der Vorteil gegenüber einer Chemotherapie und erlaubt es, auch solche Tumore noch wirksam und zielgerichtet zu behandeln, die viele kleine Tochtergeschwülste im Körper gebildet haben und somit weder operiert noch von aussen bestrahlt werden können.
Enge Zusammenarbeit mit Kliniken
Dort, wo Ärzte zurzeit keine Behandlungsmöglichkeiten mehr haben, da setzen wir mit unserer Forschung an
, betont Roger Schibli, Leiter des Zentrums für radiopharmazeutische Wissenschaften (ZRW), einer gemeinsamen Einrichtung des PSI, der ETH Zürich und des Universitätsspitals Zürich. Die Zusammenarbeit mit den Medizinern ist ihm wichtig, denn sie wissen am besten, bei welchen Krankheiten nuklearmedizinische Verfahren sinnvoll sind. Die Suche nach dem Wie und Womit übernehmen dann die Forschenden des ZRW. Allein am PSI versuchen fünf Arbeitsgruppen, die besten Radiopharmaka für verschiedene Krebsarten und andere Krankheiten zu entwickeln. Sie sollen schnell im Körper aufgenommen werden, sich spezifisch an die gesuchten Zellen binden und andere Gewebe schnell wieder verlassen, um dort keinen Schaden anzurichten. Daneben sollen sie eine Halbwertszeit haben, die lang genug ist, um eine ausreichende Untersuchung oder Behandlung zu gewährleisten und eine Strahlung abgeben, die von den Kameras der Untersuchungsgeräte gut erfasst werden kann. Es gibt kein ideales Radiopharmakon, das für alle Anwendungen gleichermassen funktioniert
, sagt Schibli, denn man unterscheidet zwischen radioaktiven Arzneimitteln für den diagnostischen Einsatz und solchen, die zur Therapie benutzt werden sollen.
Dabei sind die Unterschiede grösser als die Gemeinsamkeiten. Für diagnostische Fragen suchen die Forscher nach Radiopharmaka, deren Strahlung eine so grosse Reichweite hat, dass man die Verteilung der Substanz im Körper mit hochempfindlichen Geräten von aussen messen und sie bildlich darstellen kann. Dafür eignen sich besonders Isotope, die Positronen- oder Gammastrahlung aussenden. Wenn ein radioaktives Arzneimittel jedoch zur Therapie genutzt werden soll, kommt es vor allem darauf an, dass die Strahlung im Zielgebiet im Körper bleibt und über eine Distanz im Millimeterbereich sehr viel Energie abgibt, wodurch ein Tumor vernichtet werden kann. Dafür eignen sich am besten Radiopharmaka, die Teilchenstrahlung aussenden, also vor allem Beta-Minus- oder Alphastrahlung.
Mehr als nur Physik
Der Weg vom physikalischen Ursprung eines Radiopharmakons bis hin zu seiner optimalen medizinischen Wirkung ist weit, dauert Jahre und schliesst oftmals die Arbeit aller fünf ZRW-Forschergruppen am PSI ein. Die Herausforderung bei unserer Arbeit ist die Interdisziplinarität. Um unsere Ziele zu erreichen, müssen wir biologische, chemische, medizinische, pharmazeutische und physikalische Aspekte berücksichtigen
, so Martin Béhé, Leiter der Forschungsgruppe Pharmakologie am ZRW. Jeder muss nicht nur von seinem Fachgebiet, sondern auch von den anderen Bereichen etwas verstehen. Das ist zwar manchmal schwierig, aber faszinierend.
Seine Arbeitsgruppe untersucht vor allem Peptide, kleinere Proteine, die auch im gesunden Körper vorkommen. Die Forscher verändern die Bestandteile der Moleküle oder ihre Struktur, damit sie ein radioaktives Isotop anhängen können, das seine Strahlung direkt zu den ausgewählten Krebszellen transportiert. Dies erfordert Spezialkenntnisse. Wir müssen einerseits wissen, aus welchen Zellen ein Tumor besteht, wie er sich entwickelt hat, welche Symptome er verursacht. Andererseits müssen wir aber auch wissen, wie sich eine Substanz, mit der wir einen Tumor diagnostizieren oder bekämpfen wollen, im Körper verhält, welche Stoffwechselwege sie durchläuft oder wie stark und wie schnell sie in den Nieren aufgenommen und wieder ausgeschieden wird
, erklärt Béhé.
Neben seiner Gruppe gibt es noch ein zweites Team von Spezialisten, die gezielt nach neuen Wirkstoffen suchen, um sie mit radioaktiven Molekülen zu koppeln. Die Gruppe Nuklid-Chemie verwendet dabei vor allem das Vitamin Folsäure, welches Krebszellen für ihr verstärktes Wachstum brauchen. Viele Tumorarten tragen an ihrer Oberfläche Folatrezeptoren, an denen ein passender chemischer Schlüssel andocken kann. Das macht sie zum perfekten Angriffsziel für radioaktiv markierte Folsäuremoleküle.
Produktion unter Argusaugen
Wenn eine der beiden Gruppen ein Radiopharmakon soweit entwickelt hat, dass man es erstmals am Menschen einsetzen kann, vergehen trotzdem noch Monate und Jahre, bis es zum Patienten gelangt. Zuerst müssen die Forscher nachweisen, dass die neue Substanz auch ein sicheres Arzneimittel ist. Dafür sorgt am ZRW die Arbeitsgruppe Klinische Versorgung, deren Spezialgebiet zum einen die hochsterile, standardisierte und damit reproduzierbare Herstellung von Radiopharmaka nach den Richtlinien der Guten Herstellungspraxis (good manufacturing practice) ist. Zum anderen gibt es in dieser Gruppe auch Mitarbeiter mit der Expertise zur Erstellung all der aufwendigen Dokumente, welche die Schweizerische Zulassungs- und Kontrollbehörde für Heilmittel, Swissmedic, für Studien am Patienten und vor der Neuzulassung eines Radiopharmakons fordert.
Dazu gehört nicht nur die genaue Beschreibung des Tracer-Moleküls, sondern auch die des radioaktiven Isotops, das angehängt wird. Zwar gibt es Hunderte von Isotopen, die für einen Einsatz im Menschen in Frage kommen, doch nur die wenigsten können in genügender Menge und Reinheit hergestellt werden. Zuerst müssen wir ein Ausgangsmaterial finden, das die gewünschte Radioaktivität liefern kann
, erklärt Schibli. Dann
, fügt er hinzu, müssen wir überlegen, wie wir das effektive Isotop vom Ausgangsmaterial trennen und was mit den Nebenprodukten passiert.
Diese Schritte liegen in der Hand zweier Arbeitsgruppen: Radionuklidentwicklung, die auch Teil des PSI-Labors für Radiochemie ist, und die Gruppe Nuklide und Betrieb.
Die Forschenden dieser beiden Gruppen haben den grössten Einfluss auf den radioaktiven Teil eines Wirkstoffs, verbessern dessen Herstellungsprozess und suchen nach neuen Isotopen. Durch die einzigartige Infrastruktur am PSI, unsere Beschleunigeranlagen und Neutronenquellen können wir auch mit Isotopen forschen, die man nur hier herstellen kann
, sagt Schibli. Das eröffnet uns die Möglichkeit, immer bessere Substanzen zu entwickeln, die den Patienten einmal helfen werden.
Obwohl die am ZRW entwickelten radioaktiven Arzneimittel bislang noch nicht für den Gebrauch im klinischen Alltag zugelassen sind, übernimmt das Zentrum eine Vorreiterrolle in der Entwicklung. Seine Radiopharmaka sind Prototypen, an denen alle wichtigen Eigenschaften bis zur standardisierten Produktion getestet worden sind. Die Ergebnisse dieser Arbeit können Firmen und Behörden als Referenz dienen, wenn Radiopharmaka neu zugelassen werden oder neue Technologien zum Einsatz kommen sollen.
Text: Sabine Goldhahn
Weiterführende Informationen
- Über die Entwicklung und Herstellung eines Medikaments am Zentrum für radiopharmazeutische Wissenschaften (ZRW) berichten die Artikel
Entwicklung eines neuen Medikaments gegen Schilddrüsenkrebs
undMedikamente punktgenau hergestellt
. - Das ZRW arbeitet auch an einer Methode, mit der radioaktive Substanzen in den Zellkern einer Krebszelle eingeschleust werden können:
Den Krebs im Inneren treffen
. - Wie PSI-Forschende effiziente Verfahren zur Erzeugung von Radionukliden für die medizinische Diagnostik entwickeln, berichtet der Artikel:
Designernuklid für medizinische Anwendungen
. - Wie Forschende am PSI Radionuklide erzeugen:
Im Fokus der Protonen
.
Kontakt
Prof. Dr. Roger Schibli, Leiter des Zentrums für radiopharmazeutische Wissenschaftendes Paul Scherrer Instituts PSI, der ETH Zürich und des Universitätsspitals Zürich
Telefon: +41 56 310 28 37, E-Mail: roger.schibli@psi.ch