Die meisten Krebszellen tragen auf ihrer Oberfläche Rezeptoren, die sie einzigartig machen. Da die Rezeptoren bis in die Zelle hineinreichen, wirken sie als Vermittler zwischen aussen und innen. Chemotherapeutische Medikamente, die aussen andocken, setzen im Inneren der Zelle eine Kaskade von biochemischen Reaktionen in Gang. An deren Ende sollen die Krebszellen absterben. Forschende am Paul Scherrer Institut PSI untersuchen jetzt eine neue Methode, um auch radioaktive Substanzen nicht nur aussen an eine Krebszelle anzuheften, sondern sie gleich bis in den Zellkern einzuschleusen. Dadurch bleibt die Strahlenquelle in der Zelle und wirkt gezielter, weil sie näher an die Erbinformation gelangt. Wenn man die passenden radioaktiven Verbindungen findet, hat dieses Wirkprinzip das Potenzial, in Zukunft bei mehreren Arten von Krebs zu helfen.
Eines der wichtigsten Ziele in der Krebstherapie ist es, die entarteten Zellen in ihrem Innersten zu treffen, also im Zellkern. Von dort startet der ganze Prozess des überschiessenden Zellwachstums, der zur Wucherung im Körper führt, denn dort liegt die Erbinformation DNA. Bei Krebszellen sorgt eine krankhaft veränderte DNA dafür, dass sich die Zelle schneller und häufiger teilt als normale Zellen. Viele Zellgifte, die in der Chemotherapie von Krebserkrankungen eingesetzt werden, schaffen es bis in den Zellkern hinein und greifen dort genau in jene Vorgänge ein, die für die Zellteilung wichtig sind. Andere wiederum stören den Stoffwechsel der Tumorzellen und behindern dadurch ihr Wachstum. Somit wirken sie alle innerhalb der Zelle und besonders dann, wenn sie sich teilt. Dennoch sind viele Zellgifte unspezifisch und attackieren auch andere Körpergewebe, die sich häufig erneuern, wie Haare oder Schleimhaut. Auch bei einer herkömmlichen Bestrahlung von aussen können gesunde Zellen Schaden nehmen. Denn durch die ionisierende Strahlung werden alle Zellen innerhalb des bestrahlten Gebietes getroffen.
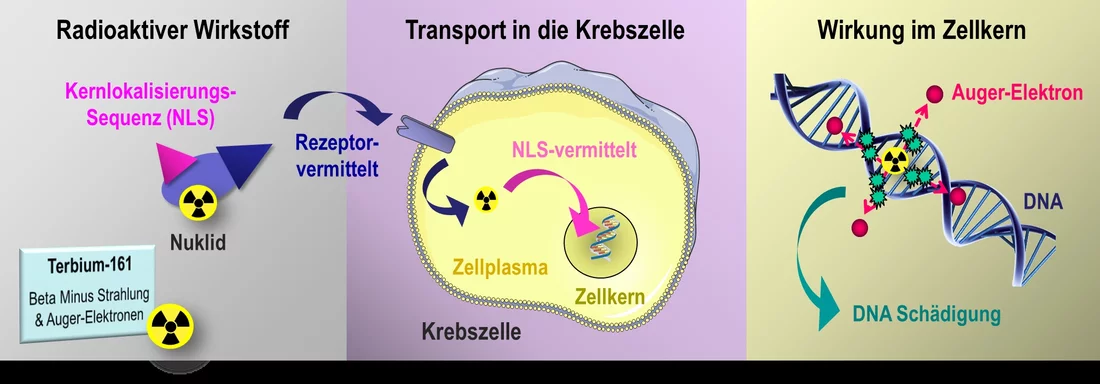
Demgegenüber wirken radioaktive Medikamente, die der Patient in den Blutkreislauf gespritzt bekommt, sehr spezifisch. Sie bestehen aus einem Komplex mehrerer Moleküle, zu denen meistens ein Eiweiss und ein radioaktives Metallatom gehören. Mit dem Eiweiss docken sie an passende Rezeptoren auf der Aussenseite der Tumorzelle an. Das daran gekoppelte Nuklid – der radioaktive Teil des Medikaments – bleibt entweder aussen am Rezeptor haften oder wird von ihm ins Zellplasma transportiert. Während das Nuklid zerfällt, sendet es Strahlung aus, die eine Reichweite von wenigen Millimetern hat. Damit durchdringt sie das Innere der Zelle sowie den Zellkern und erreicht auch benachbarte Zellen. Das Nuklid selbst gelangt jedoch nicht bis in den Zellkern hinein. Das verhindert eine schützende Kernhülle, die ihn umgibt.
Auf zwei Wegen zum Ziel
Die Pharmazeutin Cristina Müller vom Zentrum für Radiopharmazeutische Wissenschaften (ZRW) am PSI untersucht jetzt gemeinsam mit ihrem Team eine Möglichkeit, um die Wirkung der radioaktiven Nuklide direkt im Zellkern noch zu verbessern. Dies gelingt ihr auf zweierlei Weise: Einerseits verwendet sie ein neues Nuklid, das bislang noch nicht bei Patienten eingesetzt wird, und andererseits koppelt sie die radioaktive Substanz mit einem zusätzlichen Eiweissmolekül, einer NLS (englisch: nuclear localization signal; Kernlokalisierungssequenz). Diese NLS kann die Kernhülle durch Bindung an Transport-Moleküle passieren und beliebige Substanzen in den Zellkern einschleusen.
Für ihre Studien verwendet Müller ein Nuklid des Elements Terbium, einem Metall der seltenen Erden. Terbium ist für die Forscherin besonders interessant, weil es davon vier verschiedene radioaktive Nuklide gibt, die unterschiedliche Strahlungsarten emittieren. Damit können sie das ganze Spektrum der nuklearmedizinischen Diagnostik und Behandlung abdecken. Trotzdem steht ihre Entwicklung für die klinische Anwendung erst am Anfang, denn einige dieser Nuklide lassen sich nur sehr schwer herstellen. Das Isotop Terbium-161, mit dem Müller aktuell arbeitet, kann am PSI produziert werden. Dort wird es in Zusammenarbeit zwischen dem ZRW und dem Labor für Radiochemie an der Neutronenquelle SINQ aus dem Element Gadolinium hergestellt.
Direktangriff im Zellkern
Terbium-161 ist ein einzigartiges Nuklid
, schwärmt Müller begeistert. Es sendet zwei Arten von Strahlung aus, die eine unterschiedliche Reichweite haben. Die beiden Strahlungsarten ergänzen sich und können daher gemeinsam in der Krebstherapie genutzt werden.
Eine dieser Strahlungsarten ist die wenige Millimeter reichende Beta-Minus-Strahlung. Diese durchdringt die ganze Zelle und Hunderte von Nachbarzellen.
Daneben emittiert Terbium-161 noch sogenannte Auger-Elektronen. Deren Reichweite ist mit weniger als einem Mikrometer viel kleiner als der Durchmesser einer Zelle. Somit würden sie an der Aussenseite einer Tumorzelle kaum einen Nutzen bringen. Im Inneren des Zellkerns jedoch können sie die DNA-Stränge schädigen, sodass sich die Zelle nicht mehr teilen kann. In unseren Experimenten an Zellkulturen haben wir jetzt gezeigt, dass dieses Prinzip wirklich funktioniert und die Zellen mehr Doppelstrangbrüche der DNA aufweisen
, erläutert die Pharmazeutin, aber nur, wenn wir die radioaktive Substanz vorher mit einer NLS koppeln.
Zum Vergleich hat die Forscherin mit ihrer Gruppe radioaktive Molekülkomplexe untersucht, die auch Terbium enthielten, aber keine NLS. Diese haben zwar ebenfalls ein Absterben der Tumorzellen bewirkt, doch war der Effekt mit einer NLS um ein Vielfaches stärker. Dazu Müller: Das ist später einmal für die Anwendung am Patienten wichtig. Wenn man weniger von dem radioaktiven Nuklid verabreichen muss, sinkt die Strahlenbelastung. Mögliche andere Nebenwirkungen müssen wir jedoch erst noch genau erforschen.
Universelles Wirkungsprinzip verspricht vielfältige Anwendung in der Krebstherapie
Müller ist überzeugt davon, dass man mit einer geeigneten Radionuklidtherapie bestimmte Krebsarten in Zukunft wirksamer und mit weniger Nebenwirkungen behandeln kann als mit einer Chemotherapie. So wäre Terbium-161 durch die sehr geringe Reichweite seiner Auger-Elektronen besonders geeignet, einzeln im Körper verstreute Krebszellen oder Zellhaufen abzutöten. Hinzu kommt, dass die Beta-Minus-Strahlung dieses Nuklids sowie seine Halbwertszeit vergleichbar mit den Werten für das Radionuklid Lutetium-177 sind. Lutetium-177 ist schon heute in der Krebsbehandlung am Patienten im Einsatz. Im Gegensatz zu Lutetium-177 hat Terbium-161 mit seinen zwei Strahlungsarten jedoch den Vorteil der doppelten Wirkung. – Und das, ohne zusätzliche Nebenwirkungen auf die Nieren zu verursachen. Dies hat die Forscherin in einer kürzlich veröffentlichten Studie an Nierengewebe von Mäusen gezeigt.
Trotz des grossen Potenzials der radioaktiven Medikamente stehen noch viele Jahre Entwicklungsarbeit bevor. Zum einen muss man herausfinden, welche Rezeptoren auf welchen Krebszellen sich am besten eignen, damit sie durch ein radioaktiv markiertes Eiweiss besetzt werden können. Dieses sollte sich so zielgerichtet anheften, dass keine anderen Zellen geschädigt werden. Zum anderen muss die Verbindung zwischen dem radioaktiven Nuklid und dem Eiweiss passen und dann noch die NLS angehängt werden. Daher untersucht Müller all diese einzelnen Parameter akribisch genau. Mit unserer Forschung wollen wir eine Optimierung der Radionuklidtherapie auf zwei Ebenen erreichen, indem wir einerseits ein effektiveres Nuklid verwenden und andererseits dieses Nuklid an den Ort bringen, wo es am besten wirkt
, betont die Wissenschaftlerin, wir wollen das ganze Potenzial, das ein Nuklid wie Terbium-161 bietet, ausnutzen.
Text: Sabine Goldhahn
Hintergrund: Beta-Minus-Strahlung vs. Auger-Elektronen
Das radioaktive Nuklid Terbium-161, das Forschende am PSI in Krebsmedikamenten untersuchen wollen, erzeugt zwei Arten von Strahlung: Beta-Minus-Strahlung sowie Auger-Elektronen. Physikalisch gesehen bestehen beide Strahlungsarten aus Elektronen, die aber einen verschiedenen Ursprung im Atom und eine unterschiedliche Bewegungsenergie haben. Die Elektronen der Beta-Minus-Strahlung entstehen, wenn ein Neutron im Atomkern zerfällt und sich dabei in ein Proton und ein Elektron umwandelt. Diese Elektronen haben eine hohe Bewegungsenergie und deswegen eine relativ grosse Reichweite im Gewebe.
Auger-Elektronen stammen hingegen aus der Elektronenhülle, die den Atomkern umgibt, aus der sie in einem komplexen Prozess herausgeschleudert werden. Ihre Energie und damit auch die Reichweite im Gewebe sind deutlich kleiner als die von Elektronen, die durch den Beta-Minus-Prozess entstehen. Während die Beta-Minus-Strahlung bereits zu medizinischen Zwecken an Patienten verwendet wird, sind Auger-Elektronen bislang erst unter Laborbedingungen im Einsatz. Mehr zum Auger-Prozess erfahren Sie auf Wikipedia.
Weiterführende Informationen
- Einen Überblick über die Arbeit des Zentrums für radiopharmazeutische Wissenschaften bietet der Artikel
Gezielt gegen Krebs
. - Über die Entwicklung und Herstellung eines Medikaments am Zentrum für radiopharmazeutische Wissenschaften berichten die Artikel
Entwicklung eines neuen Medikaments gegen Schilddrüsenkrebs
undMedikamente punktgenau hergestellt
. - Wie PSI-Forschende effiziente Verfahren zur Erzeugung von Radionukliden für die medizinische Diagnostik entwickeln, berichtet der Artikel:
Designernuklid für medizinische Anwendungen
. - Wie Forschende am PSI Radionuklide erzeugen:
Im Fokus der Protonen
.
Kontakt/Ansprechpartner
PD Dr. Cristina Müller, Leiterin der Gruppe Nuklid-Chemie des Zentrums für radiopharmazeutische Wissenschaften des Paul Scherrer Instituts PSI, der ETH Zürich und des Universitätsspitals ZürichPaul Scherrer Institut, 5232 Villigen PSI
Telefon: +41 56 310 44 54, E-Mail: cristina.mueller@psi.ch