Au PSI, les chercheurs décryptent la structure des protéines de bactéries et de virus. Leurs connaissances permettent de développer des médicaments contre des maladies infectieuses. Mais avant de pouvoir commencer l’analyse, il faut résoudre un problème épineux: la cristallisation de ces molécules.
Chia-Ying Huang se saisit du coupe-verre. D’un geste prudent mais déterminé, elle détache un petit morceau de la mince plaque de verre qui se trouve en face d’elle. L’observateur découvre alors que la plaque en question, qui semblait faite d’un seul bloc, renferme en réalité une mince feuille. Avec son scalpel, Chia-Ying Huang en prélève un peu et finit par brandir au bout d’une pince un morceau de cette feuille, large de quelques millimètres seulement. «C’est là que se trouvent mes cristaux», annonce-t-elle fièrement.
A l’œil nu, on ne remarque rien. Ce n’est que lorsque Chia-Ying Huang place la feuille sous son microscope que même l’observateur le plus suspicieux doit admettre qu’elle a raison: des dizaines de cristaux incolores apparaissent au bord d’une gouttelette de liquide emprisonnée dans le film. Les cubes translucides font penser à de minuscules diamants. Chia- Ying Huang fixe le précieux morceau de feuille sur un support et le plonge dans une cuvette remplie d’azote liquide, où d’autres échantillons – conservés dans le froid glacial de l’azote – attendent déjà d’être mesurés à la Source de Lumière Suisse SLS.
Chia-Ying Huang est biochimiste et travaille depuis quatre ans comme cristallographe à la SLS. Auparavant, elle était en poste au Trinity College de Dublin, en Irlande, où elle a développé une nouvelle méthode qui permet de cristalliser des protéines dans de minuscules quantités de liquide, emprisonnées entre deux minces feuilles de plastique. Déjà, à l’époque, elle travaillait en coopération avec les chercheurs à la SLS. Ses collègues du PSI profitent à présent de cette technique, de même que tous les utilisateurs externes qui recourent à la SLS pour décrypter la structure de ce qu’on appelle des «protéines membranaires». Ces biomolécules – qui sont ancrées à l’état naturel dans la membrane des cellules des bactéries, des animaux et des êtres humains – revêtent une grande importance d’un point de vue médical: un bon tiers des médicaments qui sont actuellement homologués agissent sur ce type de protéines. Mais les protéines membranaires ont une propriété qui rend leur cristallisation particulièrement difficile: elles ne sont pas solubles dans l’eau. D’où la nécessité de disposer de méthodes de cristallisation particulièrement sophistiquées.
Si petits et si convoités
L’effort en vaut la peine, car, pour étudier la fonction des protéines et développer par exemple des médicaments contre certains virus ou certaines bactéries, les chercheurs doivent connaître précisément leur structure. L’analyse de la structure cristalline est le moyen le plus fiable pour y parvenir. Elle consiste à radiographier des cristaux avec la lumière synchrotron; le diagramme de diffraction qui en résulte permet de déterminer la structure des molécules, entre autres grâce à des méthodes de calcul complexes. Pour que cela fonctionne, il faut néanmoins que les molécules protéiques s’agencent pour former un schéma tridimensionnel régulier: autrement dit, un cristal.
«La cristallisation des protéines, c’est le goulot d’étranglement de toute la biologie structurale», explique May Sharpe. Cette cristallographe dirige le site de production des cristaux, une installation du PSI qui aide les utilisateurs internes comme externes à faire pousser les cristaux dont ils ont besoin pour leur recherche. «En même temps, cette branche scientifique est auréolée de quelque chose de presque magique», souligne May Sharpe. Car il n’existe pas de recette miracle pour faire pousser des cristaux: en dépit de nombreuses décennies de recherche, les expériences restent pour la plupart fondées sur des tâtonnements.
Lorsqu’on veut faire pousser des cristaux de sel de cuisine ou de sucre, il suffit de dissoudre une importante quantité de matière première dans de l’eau et de laisser reposer la solution pendant un moment pour, en règle générale, voir apparaître de superbes cristaux. Mais avec des protéines, cela ne fonctionne pas aussi facilement, car il s’agit de molécules complexes avec une structure tridimensionnelle compliquée.
Elles rechignent à s’agencer en formations régulières, qui restent toujours relativement lâches. «Pour que ce soit possible, elles doivent être très pures et très stables, résume May Sharpe. Nous aimons volontiers dire que nos protéines doivent être heureuses.»
Les protéines membranaires avec lesquelles Chia- Ying Huang travaille sont particulièrement délicates. «Elles ne sont vraiment stables que dans leur environnement d’origine: la membrane cellulaire», explique la cristallographe. Obtenir ce type de protéines à partir des cellules, sans membrane et dans un état suffisamment pur pour pouvoir cultiver des cristaux, représente un grand défi.
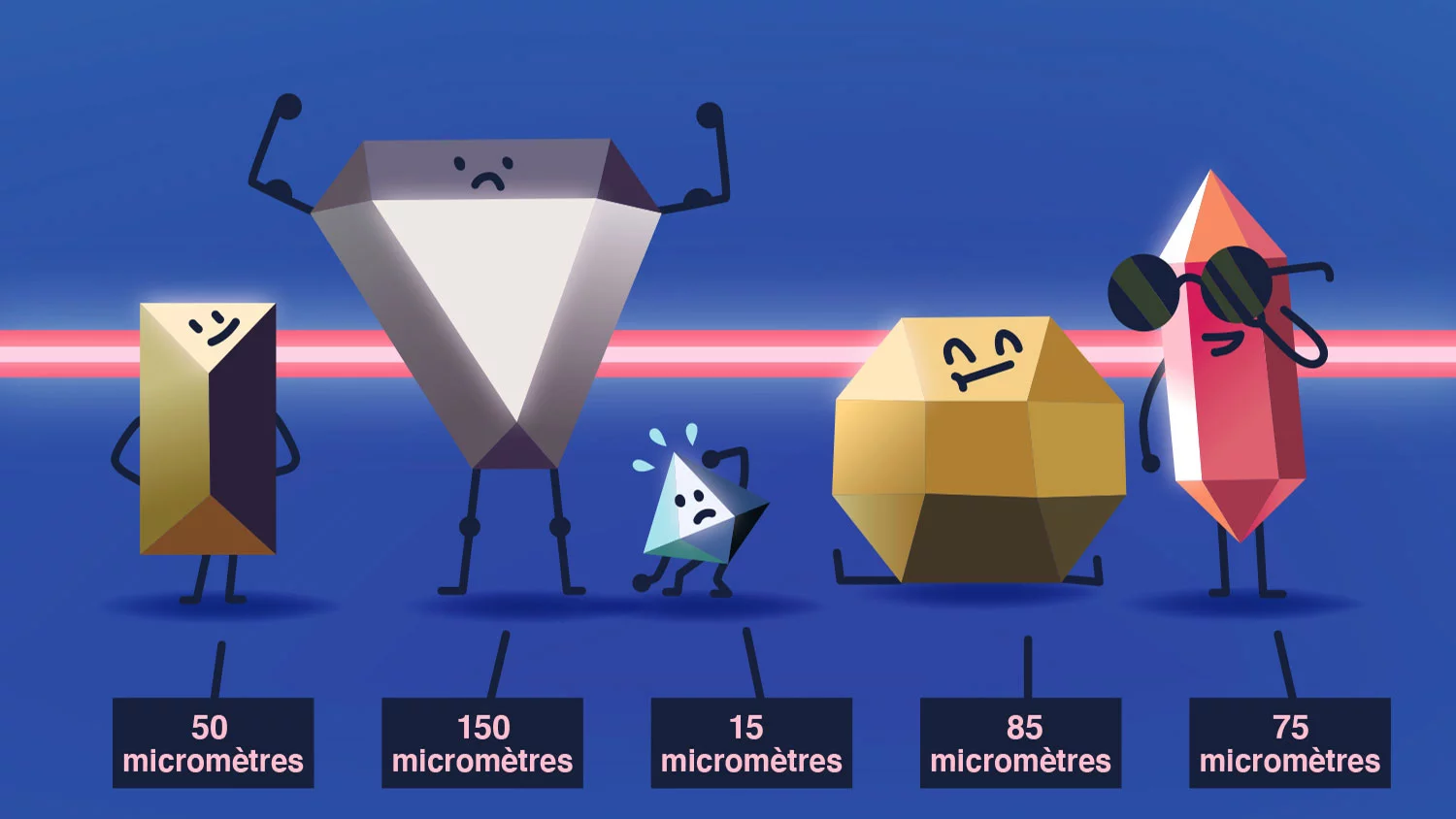
Les cristaux de protéines sont minuscules, surtout comparés à un cristal de roche comme ceux qui sont exposés dans les musées de géologie. Lorsqu’on a de la chance, les cristaux de protéines croissent et atteignent la taille d’un demi-millimètre. D’autres restent si petits qu’ils ne sont visibles qu’au microscope.
Il faut beaucoup de conviction
Dans le laboratoire de Chia-Ying Huang à la SLS, un robot pipetteur passe lentement sur une plaque de plastique creusée de cavités appelées «wells» («puits»). Dans chacune d’elles, il dépose de minuscules quantités de solution protéique, tout juste un dix-millième de millilitre. D’habitude, le robot ajoute ensuite un mélange déjà prêt, composé d’eau, de sels et d’adjuvants chimiques qui, au fil du temps, se sont révélés favorables à la formation de cristaux.
Mais comme les protéines membranaires ne se dissolvent pas dans l’eau, Chia-Ying Huang procède ici différemment: soit elle ajoute une substance qui stabilise les protéines, soit elle remplace l’eau comme solvant par des lipides, c’est-à-dire des biomolécules lipophiles. Selon la méthode qu’elle a elle-même développée, le robot dépose la protéine, les lipides et les substances adjuvantes entre deux feuilles, qui vont emprisonner complètement les minuscules gouttes de lipides. Le liquide est ainsi conservé de manière sûre, à l’abri de l’air et de l’humidité.
«Avec cette méthode, les cristaux de certains types de protéines membranaires poussent beaucoup mieux, relève Chia-Ying Huang. Et il y a encore un autre avantage: il n’est plus nécessaire de les retirer de la solution, une fois qu’ils se sont formés.» A la place, Chia-Ying Huang utilise simplement l’instrument de découpe pour détacher de la plaque la goutte filmée avec les cristaux.
Les protéines membranaires de Chia-Ying Huang fournissent des cristaux particulièrement petits: la longueur de leurs arêtes atteint seulement un dixième, voire un centième de millimètre. «Lorsque les cristaux sont aussi petits, les rayons X de la SLS les détruisent facilement, souligne-t-elle. Nous devons donc en mesurer beaucoup à la suite pour obtenir suffisamment de données.» Heureusement, quand tout fonctionne bien, plusieurs centaines de cristaux poussent directement à partir de chaque échantillon. Ils sont balayés et mesurés l’un après l’autre par les rayons X de la SLS. La méthode qui rend cela possible est appelée «cristallographie sérielle».
Des milliers de lits à l’hôtel des plaques
L’«hôtel des plaques» – c’est ainsi que les chercheuses désignent la grande armoire de laboratoire tempérée à 20 degrés Celsius – forme le cœur du site de production des cristaux au PSI. Il abrite jusqu’à mille plaques en plastique, dont chacune réunit des dizaines d’échantillons. Les chercheurs attendent qu’il se passe quelque chose dans les solutions protéiques et, plus précisément, que des cristaux apparaissent. Régulièrement, les plaques sont passées de manière automatique sous un appareil photo qui réalise et enregistre un cliché de chaque well.
Chia-Ying Huang examine des images de l’une de ces séries de tests sur l’écran de son ordinateur. «Cela fait déjà trois semaines que les solutions sont là-dedans, mais on ne voit toujours rien», dit-elle en désignant les innombrables photos de gouttes incolores. Elle ne se laisse pas gagner par la frustration pour autant. «D’habitude, il faut un mois pour que des cristaux se forment», rappelle-t-elle. Mais il n’est pas rare non plus qu’il ne se passe rien. A l’aide du robot pipetteur, la cristallographe prépare alors de nouvelles solutions protéiques d’une autre composition: elle augmente la concentration de protéines, change de solvant ou ajoute des additifs. Et attend de nouveau.
Les protéines ne mettent pas toujours la patience des chercheuses à rude épreuve. Au contraire, il arrive que des cristaux apparaissent précipitamment, à partir de la solution, en gros amas désordonné. Mais la qualité des solides qui se forment alors n’est pas suffisante pour une analyse de la structure cristalline, car les molécules ne se sont pas agencées en schémas réguliers. Là aussi, cela veut dire qu’il faut réessayer, cette fois avec peut-être une solution diluée.
Sur le fond, vous fixez les gouttes tout le temps.
«La cristallisation de protéines est un travail ingrat, admet May Sharpe en riant. Sur le fond, on passe son temps à fixer des gouttes. La plupart des chercheurs n’aiment pas ça, mais moi, ça me plaît beaucoup.» Sa passion pour cette spécialité, la chercheuse l’a développée pendant sa thèse de doctorat chez Novartis, l’entreprise biotechnologique et pharmaceutique bâloise, où elle faisait de la recherche dans le domaine de la cristallisation de protéines pour le développement de principes actifs. Cette étape – que ses collègues considèrent comme nécessaire mais guère plaisante – n’a pas tardé à éveiller son intérêt.
«Cela m’amuse de tester une foule de choses différentes, explique-t-elle. Et c’est gratifiant d’aider les autres à obtenir ces cristaux si convoités.» Ce que May Sharpe a appris sur la culture de cristaux de protéines au cours de ses huit ans au PSI? «Qu’il ne faut pas trop réfléchir, répond-elle. Juste voir ce qui se passe et en tirer des enseignements. Et surtout qu’il faut se défaire de l’idée de toujours tout comprendre de ce qui arrive ici.» Car c’est précisément ce qui constitue la composante presque magique de son travail et de la plongée dans l’univers des microbes.
Texte: Brigitte Osterath
Droit à l'utilisation
Le PSI fournit gratuitement des images et/ou du matériel vidéo pour la couverture médiatique du contenu du texte ci-dessus. L'utilisation de ce matériel à d'autres fins n'est pas autorisée. Cela inclut également le transfert des images et du matériel vidéo dans des bases de données ainsi que la vente par des tiers.